Dışkı Örneklerinde
Parazitolojik Tanı
Dr. Oğuz Şenbil,
* Uzm.; Türk Telekom Sağ.
Merk. Klinik Mik. ve Enf. Hastalıkları
Dışkının parazitolojik yönden incelenmesi denince akla serum fizyolojikle
dışkının lam üzerinde emülsiye edilmesi ve 100 ve 400' lük büyütmelerle
incelenmesi gelir. Oysa doğrudan taze bakı tek başına (hele organizma sayısı az
olduğunda) kesinlikle yetersiz olup; bu yöntem ile parazit görülememesi durumunda
geçici boyama, konsantrasyon yöntemleri, kalıcı boyama, selofan band ya da
non-mikroskobik yöntemlerin bir ya da birkaçı birarada uygulanmalıdır. Yöntemlerin
hemen hepsi fazla bir maliyet ve emek değil, yalnızca deneyim gerektiren yöntemlerdir.
1. Dışkının
toplanması ve saklanması: Barsak parazit enfeksiyonlarının çoğunda tanı dışkıda
helment yumurta larvalarının ve protozoon trofozoit ya da kistlerinin saptanmasıyla
konur. Bu nedenle dışkı örneklerinin doğru biçimde toplanması ve saklanması
büyük önem taşır.
Rutin parazitolojik incelemeler için gerekli dışkı miktarı şekilli
dışkılar için yaklaşık iri bir ceviz büyüklüğünde (30 g), sulu dışkılar
içinse 5-6 çorba kaşığı hacmindedir.
Dışkısı incelenecek hastanın 10 gün önceden beri antibiyotik, bizmut, madeni
yağ, kaolin, laksatif ya da antidiareik ilaçlar almamış olması gerekir.
Dışkı örnekleri temiz ve geniş ağızlı, ağzı sıkıca kapanabilen kaplarda
toplanmalıdır. Bir çok protozoa dışkıyla aralıklı olarak atıldığından 2-3
günlük aralarla en az 3 dışkı örneğinin incelenmesi önerilir. Helment ve
yumurtalarının saptanmasında dışkı örneklerinden birisi magnezyum sülfat gibi
tuzlu bir laksatif uygulaması ile elde edilebilir. |
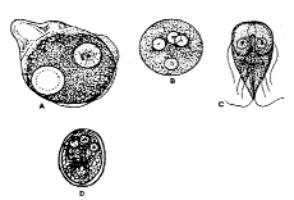
|
A:Tek çekirdekli ve bir alyuvar yutmuş (içteki kesikli çizgi
bir alyuvarı temsil eder) E histolytica trafozoti. B: 4 çekirdekli E histolytica kisti.
C: G lamblia trofozoiti. D: G lamblia kisti 1200 x.
Protozoa trofozoitleri genellikle sıvı ve diareli
dışkılarda bulunur; bu tür dışkılar dışkılamadan sonraki ilk 30 dakika içinde
incelenmelidir, şekilli dışkılar alındıkları gün içinde incelenmelidir; bu
olanaklı değilse, bir sonraki güne kadar bir fiksatifin içinde ya da dışkı
kabının kapağı iyice kapatılarak buzdolabında (3-5 ºC) saklanabilir. Fiksasyonda
genellikle kullanılan oran 3 kısım fiksatife 1 kısım dışkıdır. Fiksasyonda
kullanılan tüm maddelerin bazı avantaj ve dezavantajları vardır. En sık kullanılan
polivinil alkol (PVA) , Schaudinn fiksatifi, %5 ya da %10 formol, mertiolat-iyot-formol
(MİF) ve sodyum asetat-asetik asit-formol (SAF)'dür.
PVA' nın en büyük avantajı, boyama için hazırlanacak yaymaların
istendiğinde hazırlanabilmesidir. Dışkı örnekleri PVA içeren sıkı kapaklı
küçük şişelerde saklanabilir, ayrıca bir lam üstünde bir pirinç
büyüklüğündeki dışkıyı birkaç damla PVA ile karıştırıp doğrudan tespit
etmekte olanaklıdır. Yayma preparatlar boyanmadan önce, oda ısısında bir gece ya da
37ºC' lik inkübatörde birkaç saat kurumaya bırakılmalıdır. Schaudinn fiksatifi
uygulanırken, bir çubuk ya da sulu boya fırçasıyla hazırlanan dışkı yaymaları
kurumadan hemen fiksatife batırılır, en az 30 dakika, en çok bir gece süreyle tespit
edilir.
MİF dışkı örnekleri için hem koruyucu hemde boya işlevi görür.; özellikle
alan çalışmalarında yararlıdır. SAF fiksasyonunun avantajı hem çoklaştırma,
hemde kalıcı boya yöntemlerinin uygulanabilmesidir. Kalıcı boya uygulanacaksa Mayer
albümini ile SAF'ta saklanmış dışkı örneğinin çökeltisinden birer damla lam
üzerinde karıştırılır, oda ısısında 30 dakika kurumaya bırakıldıktan sonra
boyanabilir.
2.
Taze ve saklanmış dışkıların saklanması: Dışkının kıvamı (şekilli, yumuşak,
gevşek ya da sulu), kanın varlığı, erişkin parazit (Ascaris, Enterobius gibi) ya da
halkaların (Taenia gibi) varlığı her zaman bildirilmelidir.
Taze ve saklanmış dışkı örneklerinin incelenmesinde
en yaygın olarak, doğrudan taze bakı (salin-lugol gibi), konsantrasyon yöntemleri
(yüzdürme ve çöktürme) ve kalıcı boya yöntemleri kullanılmaktadır. Doğrudan
taze bakı hareketli trofozoitlerin araştırılmasında yararlıdır, organizmaların
sayısı az olduğunda yetersiz kalabilir. Özellikle amip trofozoitlerinin hareketini
artırmak amacı ile salin preparatı incelenmeden önce ısıtılmış madeni bir
paranın üzerinde kısa süre bekletilebilir; ancak amiplere doğrudan bakı ile özgül
tanı konmaya çalışılmamalı, tanı kesinlikle kalıcı boyalı yayma
preparatlarının incelenmesi ile konmalıdır
Direk bakılarda en sık kullanılan geçici boyalar D'Antoni ve lugol solüsyonu
gibi iyotlu bileşikler, MİF solüsyonu ve tanponlanmış metilen mavisi solüsyonudur.
Bazı laboratuvarlarda kullanılan %1'lik eosin-salin solüsyonu ile boya almayan canlı
organizmalar, pembe-kırmızı zemin üzerinde kolaylıkla ayırt edilebilir.
Konsantrasyon yöntemlerinin amacı, direk bakıda ve kalıcı boyalı
preparatlarda gözden kaçabilen seyrek organizmaları ortaya çıkarmaktır. Yüzdürme
(flotasyon) ve çöktürme (sedimentasyon) olarak iki bölümde incelenir. Çöktürme
yöntemlerinin avantajı dışkıdaki bütün parazitleri çöktürmesi; en büyük
dezavantajı ise çöken aşırı dışkı artığının parazitlerin varlığını
maskeleyebilmesidir. En sık kullanılan formol-etil asetat yöntemi zaman alıcı
olduğundan bazı laboratuvarlarda bu yöntemin modifiye edilmiş bir şekli
kullanılmaktadır. Yüzdürme yöntemlerinin temel prensibi ise yüksek özgül
ağırlıklı solüsyonların parazitleri yüzdürmesidir. Yüzdürme sonrası elde edilen
materyel dışkı artıklarından oldukça arınmıştır ve parazitler daha kolay ayırt
edilir. Ancak bir çok ağır sestod ve tremetod yumurtası yüzmez; ayrıca kısa sürede
incelenmediğinde yumurta ve kist duvarları büzüşerek tanıyı güçleştirebilir.
Yaygın kullanılan çinkosülfat yüzdürme yöntemidir.

3.
Kalıcı boyalı yaymaların hazırlanışı:
Her dışkı örneğinde hazırlanması önerilen kalıcı boyalı yaymaların, organizmaların morfolojik
yapılarının immersiyon objektifi ile ayrıntılı olarak izlelenebilmesi , seyrek
rastlanmaları ya da küçük olmaları nedeni ile gözden kaçabilen parazitlerin daha
kolay saptanabilmesi, incelemenin ertelenebilmesi, preparatların saklanabilmesi, pozitif
preparatların referans olarak kullanılabilmesi, kuşkulu tanılarda preparatların
gönderilerek konsültasyon istenebilmesi gibi bir çok önemli avantajları vardır. En
yaygın kullanılanları trikrom ve demir hemotoksilen boyalarıdır. Demir hematoksilene
oranla daha kolay ve daha az zaman alıcı olan trikrom boyası özellikle Blastocystis
hominis, Dientamoeba fragilis gibi direk taze bakı ile tanınması güç organizmaların
tanısında çok yararlıdır. Ancak bu kalıcı boyalar Cryptosporidium enfeksiyonların
tanısında değer taşımazlar; bu enfeksiyonun tanısında çeşitli acid-fast boyaları
yararlı bulunmuştur. En sık kullanılanlardan modifiye acid-fast boyası ısı
gerektirirken, Kinyoun' un karbol-fuksin boyasında ısıya gereksinim yoktur. Son
yıllarda önemi artan Microsporidia enfeksiyonlarının tanısında ise modifiye trikrom
mavisi boyama yöntemi gibi özel yöntemlere gereksinim vardır.
4.
Diğer yöntemler:
Yumurtaları genellikle dışkıda görülmeyen Enterobius vermicularis' in
tanısında kullanılan selofan band yöntemi tuvalet ya da banyodan önce uygulanmalı;
hastanın enfekte olmadığını söyleyebilmek için en az 3-4 gün arka arkaya
yinelenmelidir. Giardia ve Strongyloides gibi duodenum yakınına tutunan parazitler için
duodenal aspirat incelemesi daha iyi sonuç verebilir; bunun bir diğer alternatifi ticari
olarak üretilmiş tel testi (Enterotest, HEDECO, Palo Alto, CA...)' dir. Bu testle ucunda
bir kapsül olan telin üst duodenuma kadar yutturulup, dört saat sonra geri
çekilmesiyle alınan örnek, mikroskopik olarak incelenir. Son yıllarda dışkıda
özellikle Giardia, Cryptosporidium ve Entamoeba türlerinin antijenlerini saptamaya
yönelik bazı ELISA ve floresan antikor ticari kitleri geliştirilmiştir. Daha çok
araştırma amaçlı olarak PCR' da kullanılmaya başlanmıştır.
Kaynaklar
1- Bilgehan H; Klinik Mikrobiyolojik Tanı. Barış Yayınları. Ankara 1992.
323-327.
2- Ok ÜZ; Dışkı örneklerinde parazitolojik tanı. 29. Türk Mikrobiyoloji
Kongresi Program ve Özet Kitabı. Güneş Kitabevi. Antalya 2000. 286-287.
3- Söyletir G, Eskitürk A; Klinik Mikrobiyoloji Laboratuvarı. İnfeksiyon
Hastalıkları. Nobel Tıp Kitabevleri. Ankara 1996. 61-86. |